La reacción de la materia orgánica con el oxígeno para producir dióxido de carbono y agua, se denomina combustión esto ocurre en muchos procesos biológicos e industriales. Una clasificación más fundamental de los tipos de reacciones, la sitúa en la categoría de oxidación-reducción. Para comprender el porqué esto es así, vamos a revisar algunos principios de óxido-reducción, empezando por la noción de número de oxidación (conocido también como estado de oxidación).
La oxidación es un cambio químico en el que un átomo o grupo de átomos pierden electrones o bien es la reacción en la que un átomo aumenta su número de oxidación. La reducción es un cambio químico en el cual un átomo o grupo de átomos ganan electrones, o también es la reacción en la que un átomo disminuye su número de oxidación. La oxidación y la reducción siempre ocurren simultáneamente ya que el número de electrones perdidos en la oxidación debe ser igual al número de electrones ganados en la reducción.
Oxidante es la especie química que captando electrones (aumentando su carga negativa o disminuyendo su carga positiva) consigue la oxidación de otra.
Reductor es la especie química que cediendo electrones (aumentando su carga positiva o disminuyendo su carga negativa) produce la reducción de otra. Por ejemplo
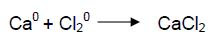
El calcio es el agente reductor puesto que pierde electrones y su carga o número de oxidación pasa de 0 a 2+. Esto se puede escribir como:

En resumen:

El oxidante se reduce y el reductor se oxida por lo que las reacciones redox transcurren entre pares conjugados de oxidación-reducción.
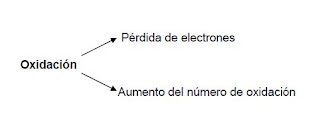
OXIDACIÓN
La oxidación tiene lugar cuando una especie química pierde electrones y en forma simultánea, aumenta su número de oxidación. Por ejemplo, el calcio metálico (con número de oxidación cero), se puede convertir en el ion calcio (con carga de 2+) por la pérdida de dos electrones, según el esquema simbólico siguiente:

En resumen:
POTENCIAL REDOX
El Potencial de electrodo, Potencial de reducción o Potencial REDOX es como se le conoce a una celda galvánica que produce por la reacción de la celda que no está en equilibrio. El potenciómetro solo permite circular una corriente pequeña, de modo que la concentración de las dos semiceldas permanece invariable. Si sustituimos el potenciómetro por un alambre, pasaría mucha más corriente, y las concentraciones variarían hasta que se alcance el equilibro. En este momento no progresaría más la reacción, y el potencial "E" se haría cero. Cuando una batería (que es una celda galvánica) se agota (V=0) los productos químicos del interior han llegado al equilibrio, y desde ese momento la batería ha <>.
RADICALES LIBRES
Los radicales libres son átomos o grupos de átomos que tienen un electrón(e-) desapareado en capacidad de aparearse, por lo que son muy reactivos.
Estos radicales recorren nuestro organismo intentando robar un electrón de las moléculas estables, con el fin de alcanzar su estabilidad electroquímica.
Una vez que el radical libre ha conseguido robar el electrón que necesita para aparear su electrón libre, la molécula estable que se lo cede se convierte a su vez en un radical libre, por quedar con un electrón desapareado, iniciándose así una verdadera reacción en cadena que destruye nuestras células. La vida biológica media del radical libre es de microsegundos; pero tiene la capacidad de reaccionar con todo lo que esté a su alrededor provocando un gran daño a las moléculas y a las membranas celulares. Los radicales libres no son intrínsecamente malos. De hecho, nuestro propio cuerpo los fabrica en cantidades moderadas para luchar contra bacterias y virus. Los radicales libres producidos por el cuerpo para llevar a cabo determinadas funciones son neutralizados fácilmente por nuestro propio sistema. Con este fin, nuestro cuerpo produce unas enzimas (como la catalasa o la dismutasa) que son las encargadas de neutralizarlos. Estas enzimas tienen la capacidad de desarmar los radicales libres sin desestabilizar su propio estado.
Las reacciones químicas de los radicales libres se dan constantemente en las células de nuestro cuerpo y son necesarias para la salud. Pero, el proceso debe ser controlado con una adecuada protección antioxidante. Un antioxidante es una sustancia capaz de neutralizar la acción oxidante de los radicales libres, liberando electrones en nuestra sangre que son captados por los radicales libres convirtiéndose en moléculas inestables.

Los radicales libres son resultado de los procesos fisiológicos propios del organismo, como el metabolismo de los alimentos, la respiración y el ejercicio, o bien son generados por factores ambientales como la contaminación industrial, el tabaco, la radiación, los medicamentos, los aditivos químicos en alimentos procesados y los pesticidas. Son átomos o moléculas extremadamente reactivas, debido a que en el orbital más externo de su estructura tienen uno o más electrones sin aparear. Esta inestabilidad les confiere una avidez física por la captura de un electrón de cualquier otra molécula de su entorno, ocasionando que la estructura afectada quede inestable (figura 1). De esta forma pueden establecer reacciones en cadena por medio de varios transportadores que se oxidan y se reducen secuencialmente, cuando un radical libre inicial modifica una biomolecula después de transferir o capturar un electrón. El daño es transmitido por medio de los transportadores, que incluso pueden ser moléculas circulantes.

Los radicales libres se forman por fuentes exógenos o endógenas. Un ejemplo de las segundas se observa en los sistemas biológicos, los cuales necesitan el oxigeno para su metabolismo energético. Aproximadamente 80% del adenosin trifosfato (ATP) que utilizamos se forma en las mitocondrias, donde se consume entre 85 y 90% del oxigeno. En ellas, el oxigeno molecular disuelto entra a la cadena respiratoria para reducirse a agua, proceso en el que son generados en forma sucesiva, el anión superóxido, el peroxido de hidrogeno y el radical hidroxilo, especies de radicales derivadas del oxigeno.
Las estructuras subcelulares de generación de radicales libres incluyen principalmente las mitocondrias, los lisosomas, los peroxisomas, así como la membrana nuclear, la citoplásmica y la del retículo endoplásmico. Una vez que el radical se genera tiene una vida media de microsegundos, corto lapso de tiempo en el que es capaz de interactuar con las biomoleculas cercanas.
Las células han desarrollado mecanismos que las protegen del efecto nocivo de los radicales libres con base en un complejo sistema de defensa constituido por los agentes antioxidantes. Así, cuando se incrementa la producción de radicales libres, estos mecanismos se activan para controlar y estabilizar el ambiente redox intra o extracelular. Los antioxidantes se definen como aquellas sustancias que, presentes en bajas concentraciones respecto a las de un sustrato oxidable (biomoleculas), retardan o previenen la oxidación. Al interactuar con el radical libre, el antioxidante cede un electrón, se oxida y se transforma en un radical libre débil no toxico.

Existen dos tipos de antioxidantes: los endógenos, dotados por el propio sistema biológico, y los exógenos, tomados de la dieta.

Para aprender mas de los radicales libres, vea el siguiente video.
BIBLIOGRAFÍA
http://gmorales.mayo.uson.mx/BALANCEO%20DE%20REACCIONES%20QUIMICAS.pdf
La oxidación es un cambio químico en el que un átomo o grupo de átomos pierden electrones o bien es la reacción en la que un átomo aumenta su número de oxidación. La reducción es un cambio químico en el cual un átomo o grupo de átomos ganan electrones, o también es la reacción en la que un átomo disminuye su número de oxidación. La oxidación y la reducción siempre ocurren simultáneamente ya que el número de electrones perdidos en la oxidación debe ser igual al número de electrones ganados en la reducción.
Oxidante es la especie química que captando electrones (aumentando su carga negativa o disminuyendo su carga positiva) consigue la oxidación de otra.
Reductor es la especie química que cediendo electrones (aumentando su carga positiva o disminuyendo su carga negativa) produce la reducción de otra. Por ejemplo
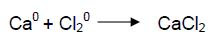
El calcio es el agente reductor puesto que pierde electrones y su carga o número de oxidación pasa de 0 a 2+. Esto se puede escribir como:

En resumen:

El oxidante se reduce y el reductor se oxida por lo que las reacciones redox transcurren entre pares conjugados de oxidación-reducción.
OXIDACIÓN
La oxidación tiene lugar cuando una especie química pierde electrones y en forma simultánea, aumenta su número de oxidación. Por ejemplo, el calcio metálico (con número de oxidación cero), se puede convertir en el ion calcio (con carga de 2+) por la pérdida de dos electrones, según el esquema simbólico siguiente:

En resumen:

POTENCIAL REDOX
El Potencial de electrodo, Potencial de reducción o Potencial REDOX es como se le conoce a una celda galvánica que produce por la reacción de la celda que no está en equilibrio. El potenciómetro solo permite circular una corriente pequeña, de modo que la concentración de las dos semiceldas permanece invariable. Si sustituimos el potenciómetro por un alambre, pasaría mucha más corriente, y las concentraciones variarían hasta que se alcance el equilibro. En este momento no progresaría más la reacción, y el potencial "E" se haría cero. Cuando una batería (que es una celda galvánica) se agota (V=0) los productos químicos del interior han llegado al equilibrio, y desde ese momento la batería ha <




http://gmorales.mayo.uson.mx/BALANCEO%20DE%20REACCIONES%20QUIMICAS.pdf
http://depa.pquim.unam.mx/amyd/archivero/serie3BalanceoRedox_6817.pdf
http://www.alumno.unam.mx/algo_leer/Envejecimiento.pdf
No hay comentarios:
Publicar un comentario